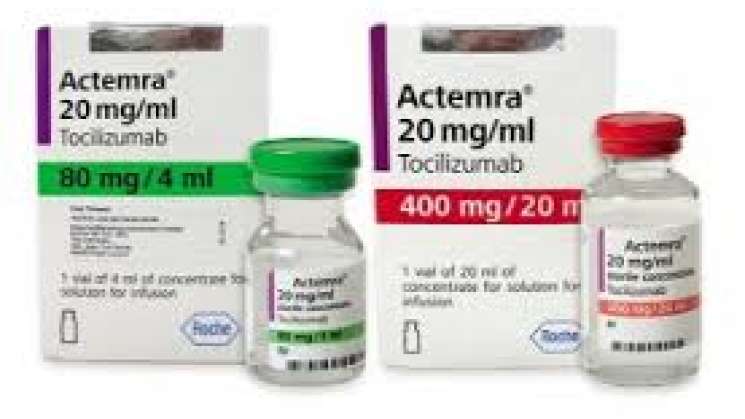
Oaxaca.-La Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) ha realizado una investigación a partir de información proporcionada por Instituciones de Salud y las denuncias interpuestas por la empresa Productos Roche, S.A. de C.V., para el producto RoActemra® (Tocilizumab) solución 80mg/4mL inyectable M.B., caja con 1 frasco ámpula de 4mL, y RoActemra® (Tocilizumab) solución 200mg/10mL, caja con 1 frasco ámpula de 10mL.
● La empresa Productos Roche, S.A. de C.V., realizó el análisis comparativo de estos, concluyendo que los productos recuperados son falsificados.
● El producto RoActemra® (Tocilizumab) identificado por la empresa Productos Roche, S.A. de C.V., como falsificado ostenta la siguiente información:
Información del medicamento original:
RoActemra®, está indicado para el tratamiento de la artritis reumatoide (AR) activa de intensidad moderada a grave, en pacientes adultos, y en el tratamiento de la Artritis Idiopática Juvenil sistémica en pacientes a partir de los 2 años de edad. Producto con Registro Sanitario 044M2009 SSA IV.
Información del producto falsificado:
Como parte del proceso interno y del análisis efectuados por la empresa Productos Roche, S.A. de C.V., se señalan las diferencias encontradas en las piezas recuperadas de los siguientes lotes del producto RoActemra® (Tocilizumab) falsificado:
|
Producto |
Presentación |
Lote |
Caducidad |
|
RoActemra® (Tocilizumab) |
80mg/4mL inyectable MB, caja con 1 frasco ámpula de 4mL |
B2080B04 |
09 AGO 2020 |
|
RoActemra® (Tocilizumab) |
80mg/4mL inyectable MB, caja con 1 frasco ámpula de 4mL |
B2096B03 |
17 ABR 2021 |
|
RoActemra® (Tocilizumab) |
200mg/10mL, caja con 1 frasco ámpula de 10mL |
B2078B01 |
24 OCT 2020 |
Empaque secundario (caja de cartón):

Empaque primario (vial):

Producto:

La COFEPRIS emite las siguientes recomendaciones:
Esta Comisión Federal continuará las acciones de vigilancia para evitar la venta de medicamentos que puedan representar un riesgo a la población, a través de la aplicación de medidas de seguridad en establecimientos que los distribuyan o comercialicen, asegurando los medicamentos ilegales, así como imponiendo las sanciones administrativas que resulten procedentes por infringir la regulación sanitaria vigente.
Para mayor información sobre medicamentos y otros insumos para la salud, se puede consultar la página Web de la COFEPRIS https://www.gob.mx/cofepris .
Te podría interesar...

Esta conversación es moderada acorde a las reglas de la comunidad “Ciudadanía Express” . Por favor lee las reglas antes de unirte a ella.
Para revisar las reglas da clic aquí
